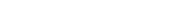Năng lượng hoạt hóa là số chi phí ít đặc biệt là nguồn năng lượng rất cần thiết để khởi đầu một phản ứng . Đó này là chiều cao của bờ rào thế năng giữa cực tiểu thế năng của chất phản ứng and mặt hàng. Năng lượng hoạt hóa được ký hiệu là E a and thông thường có đơn vị chức năng là kilojoules trên mol (kJ / mol) hoặc kilocalories trên mol (kcal / mol). Thuật ngữ “nguồn năng lượng hoạt hóa” được nhà khoa học Thụy Điển Svante Arrhenius đưa ra vào khoảng thời gian 1889. Phương trình Arrhenius liên hệ nguồn năng lượng hoạt hóa với gia tốc một phản ứng hóa học xẩy ra:
trong các số đó k là thông số gia tốc phản ứng, A là thông số tần số của phản ứng, e là số vô tỉ (giao động bằng 2,718), E a là nguồn năng lượng hoạt hóa, R là hằng số khí phổ and T là độ ẩm tuyệt đối ( Kelvin).
Bài Viết: Năng lượng hoạt hóa là gì
Từ phương trình Arrhenius, có khả năng cảm thấy cảm thấy rằng gia tốc của phản ứng biên tập theo độ ẩm. Đôi khi, vấn đề đó nghĩa là phản ứng hóa học xẩy ra nhanh hơn ở nhiệt chiều cao hơn nữa. Thế nhưng, chứa một vài tình huống “nguồn năng lượng hoạt hóa âm”, trong các số đó gia tốc phản ứng giảm theo độ ẩm.
Tại sao cần nguồn năng lượng Action?
Nếu như bạn trộn hai hóa chất cùng nhau, chỉ một vài nhỏ va chạm sẽ xẩy ra tự nhiên trong số những phân tử chất phản ứng để có thể tạo nên mặt hàng. Điều đó nổi biệt đúng nếu các phân tử có động năng thấp . Do đó, trước lúc một trong những phần đáng chú ý của chất phản ứng có khả năng được chuyển hóa thành mặt hàng, nguồn năng lượng chủ quyền của hệ phải được giải quyết và khắc phục. Năng lượng hoạt hóa vừa lòng cho phản ứng mà cần thêm một chút lực đẩy để khởi đầu. Ngay đến các phản ứng tỏa nhiệt cũng cần được nguồn năng lượng hoạt hóa để khởi đầu. Ví dụ, một đống gỗ sẽ không còn tự cháy. Một que diêm sáng có khả năng vừa lòng nguồn năng lượng Action để khởi đầu quá trình đốt cháy. Khi phản ứng hóa học khởi đầu, nhiệt lượng do phản ứng tỏa ra sẽ vừa lòng nguồn năng lượng hoạt hóa để chuyển hóa nhiều chất phản ứng thành mặt hàng hơn.
Xem Ngay: Memory Foam Là Gì
Thông thường một phản ứng hóa học trình làng mà hoàn toàn không cần thêm bất kỳ nguồn năng lượng bổ sung cập nhật update nào. Trong tình huống này, nguồn năng lượng hoạt hóa của phản ứng thường được vừa lòng bởi nhiệt từ độ ẩm thiên nhiên và môi trường bao vây. Nhiệt làm tăng hoạt động vui chơi của các phân tử chất phản ứng, cải tổ Xác Suất va chạm của chúng cùng nhau and tăng lực va chạm. Sự phối hợp này làm cho các link giữa chất phản ứng có rất nhiều tài năng bị phá tan, cho phép dựng nên các mặt hàng.
Chất xúc tác and nguồn năng lượng Action
Chất làm giảm nguồn năng lượng hoạt hóa của phản ứng hóa học được gọi bằng chất xúc tác . Về cơ bản, chất xúc tác hoạt động bằng phương pháp biên tập trạng thái chuyển tiếp của phản ứng. Các chất xúc tác không trở nên tiêu thụ bởi phản ứng hóa học and chúng không làm biên tập hằng số cân đối của phản ứng.
Xem Ngay: Hereinafter Là Gì – Nghĩa Của Từ Hereinafter
Quan hệ giữa nguồn năng lượng Action and nguồn năng lượng Gibbs
Năng lượng hoạt hóa là một trong thuật ngữ trong phương trình Arrhenius được sử dụng để đo lường và tính toán nguồn năng lượng rất cần thiết để đánh bại trạng thái chuyển đổi từ chất phản ứng thành mặt hàng. Phương trình Eyring là một trong mối quan hệ khác biểu đạt gia tốc phản ứng, ngoại trừ việc sửa chữa vì sử dụng nguồn năng lượng hoạt hóa, nó bao gồm nguồn năng lượng Gibbs của trạng thái chuyển tiếp. Năng lượng Gibbs của không ít tác nhân trạng thái chuyển tiếp sau cả entanpi and entropi của phản ứng. Năng lượng Action and nguồn năng lượng Gibbs có tác động cùng nhau, nhưng không hề hoán đổi lẫn nhau.
Deutsch Español български Türkçe Nederlands čeština Русский язык हिन्दी 日本語 polski Bahasa Melayu Svenska português Українська român 한국어 العربية ελληνικά tiếng việt ภาษาไทย Italiano Bahasa Indonesia slovenčina српски Français Suomi dansk magyar
Thể Loại: Giải bày trình diễn Kiến Thức Cộng Đồng